

ที่มา : http://www.kme10.com/mo4y2552/mo403/noname19.htm
 ไนโตรเจนเป็นอโลหะหมู่ที่ VA พบมากในรูปของธาตุอิสระและสารประกอบ ในรูปของธาตุอิสระ คือ (N2) พบในอากาศ ในอากาศมี N2 อยู่ประมาณร้อยละ 78.09 โดยปริมาตร ในรูปของสารประกอบพบในกรดอะมิโนโปรตีน แอมโมเนีย (NH3) สารประกอบไนเตรตต่าง ๆ เช่นโพแทสเซียมไนเตรต (KNO3) แอมโมเนียมไนเตรต(NH4NO3) ก๊าซไนโตรเจนเตรียมได้จากอากาศ โดยนำอากาศสะอาดและแยกก๊าซ CO2 ไอน้ำออกแล้วมาเพิ่มความดัน ลดอุณหภูมิก๊าซออกซิเจนจะเป็นของเหลวก่อนที่อุณหภูมิ -183 C แยกออกซิเจนเหลวออกเมื่อเพิ่มความดันขึ้นอีก และลดอุณหภูมิ ถึง -196 C ก๊าซไนโตรเจนจะกลายเป็นของเหลว แยกก๊าซอื่น ๆ ออกก็จะได้ไนโตรเจนเหลว เมื่ออุณหภูมิเพิ่มขึ้น และความดันลดลงก็จะกลายเป็นก๊าซไนโตรเจน ไนโตรเจนเป็นอโลหะหมู่ที่ VA พบมากในรูปของธาตุอิสระและสารประกอบ ในรูปของธาตุอิสระ คือ (N2) พบในอากาศ ในอากาศมี N2 อยู่ประมาณร้อยละ 78.09 โดยปริมาตร ในรูปของสารประกอบพบในกรดอะมิโนโปรตีน แอมโมเนีย (NH3) สารประกอบไนเตรตต่าง ๆ เช่นโพแทสเซียมไนเตรต (KNO3) แอมโมเนียมไนเตรต(NH4NO3) ก๊าซไนโตรเจนเตรียมได้จากอากาศ โดยนำอากาศสะอาดและแยกก๊าซ CO2 ไอน้ำออกแล้วมาเพิ่มความดัน ลดอุณหภูมิก๊าซออกซิเจนจะเป็นของเหลวก่อนที่อุณหภูมิ -183 C แยกออกซิเจนเหลวออกเมื่อเพิ่มความดันขึ้นอีก และลดอุณหภูมิ ถึง -196 C ก๊าซไนโตรเจนจะกลายเป็นของเหลว แยกก๊าซอื่น ๆ ออกก็จะได้ไนโตรเจนเหลว เมื่ออุณหภูมิเพิ่มขึ้น และความดันลดลงก็จะกลายเป็นก๊าซไนโตรเจน
  ประโยชน์ ประโยชน์
 ไนโตรเจนเหลวซึ่งมีอุณหภูมิต่ำมาก (-196 C) ใช้สำหรับแช่แข็งอาหารประเภทต่าง ๆ แช่แข็งเลือด เซลล์ไขกระดูกหรือส่วนต่าง ๆ ของร่างกายเพื่อช่วยยืดอายุในการเก็บรักษาใช้เตรียมก๊าซแอมโมเนีย (NH3) และกรดไนตริก (NHO3) ก๊าซแอมโมเนียที่ได้ใช้เป็นสารตั้งต้นในการผลิตปุ๋ยยูเรีย (NH2CONH2) ปุ๋ยแอมโมเนียซัลเฟต (NH4) 2SO4) ปุ๋ยแอมโมเนียไนเตรต (NH4NO3) และใช้ในอุตสาหกรรมการผลิตโซดาแอชหรือโซเดียมคาร์บอเนต(Na2CO3) ส่วนกรดไนตริกใช้ในอุตสาหกรรมทำสี ไหมเทียมทำวัตถุระเบิด ทำปุ๋ยไนเตรต เป็นต้น นอกจากนี้ไนโตรเจนยังเป็นองค์ประกอบของสารอาหาร ที่สำคัญของสิ่งมีชีวิตอีกด้วยคือเป็นองค์ประกอบในโปรตีนทุกชนิด ไนโตรเจนเหลวซึ่งมีอุณหภูมิต่ำมาก (-196 C) ใช้สำหรับแช่แข็งอาหารประเภทต่าง ๆ แช่แข็งเลือด เซลล์ไขกระดูกหรือส่วนต่าง ๆ ของร่างกายเพื่อช่วยยืดอายุในการเก็บรักษาใช้เตรียมก๊าซแอมโมเนีย (NH3) และกรดไนตริก (NHO3) ก๊าซแอมโมเนียที่ได้ใช้เป็นสารตั้งต้นในการผลิตปุ๋ยยูเรีย (NH2CONH2) ปุ๋ยแอมโมเนียซัลเฟต (NH4) 2SO4) ปุ๋ยแอมโมเนียไนเตรต (NH4NO3) และใช้ในอุตสาหกรรมการผลิตโซดาแอชหรือโซเดียมคาร์บอเนต(Na2CO3) ส่วนกรดไนตริกใช้ในอุตสาหกรรมทำสี ไหมเทียมทำวัตถุระเบิด ทำปุ๋ยไนเตรต เป็นต้น นอกจากนี้ไนโตรเจนยังเป็นองค์ประกอบของสารอาหาร ที่สำคัญของสิ่งมีชีวิตอีกด้วยคือเป็นองค์ประกอบในโปรตีนทุกชนิด
ที่มา : http://www.kme10.com/mo4y2552/mo403/noname19.htm
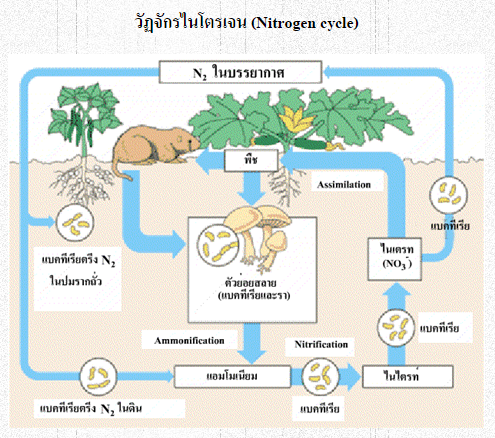
 วัฏจักรไนโตรเจนเป็นดังนี้ วัฏจักรไนโตรเจนเป็นดังนี้
 1. การตรึงไนโตรเจนโดยปรากฏการณ์ธรรมชาติ เกิดจากฟ้าแลบ ฟ้าร้อง ฟ้าผ่า หรือปรากฏการณ์ อื่นที่ทำให้เกิดความร้อนสูง ทำให้ก๊าซไนโตรเจนทำปฏิกิริยากับก๊าซออกซิเจน ได้ก๊าซ NO และก๊าซ NO ที่ เกิดขึ้นทำปฏิกิริยากับก๊าซออกซิเจน ต่อไปได้ก๊าซ NO2 1. การตรึงไนโตรเจนโดยปรากฏการณ์ธรรมชาติ เกิดจากฟ้าแลบ ฟ้าร้อง ฟ้าผ่า หรือปรากฏการณ์ อื่นที่ทำให้เกิดความร้อนสูง ทำให้ก๊าซไนโตรเจนทำปฏิกิริยากับก๊าซออกซิเจน ได้ก๊าซ NO และก๊าซ NO ที่ เกิดขึ้นทำปฏิกิริยากับก๊าซออกซิเจน ต่อไปได้ก๊าซ NO2
  N2 (g) + O2 (g) ----> 2NO(g) ดูดพลังงาน 180.6 kJ N2 (g) + O2 (g) ----> 2NO(g) ดูดพลังงาน 180.6 kJ
  2NO(g) + O2 (g) -----> 2NO2 (g) คายพลังงาน 114.2 kJ 2NO(g) + O2 (g) -----> 2NO2 (g) คายพลังงาน 114.2 kJ
  เมื่อฝนตกก๊าซ NOv จะทำปฏิกิริยากับน้ำฝนกลายเป็นกรดไนตริกดังสมการ เมื่อฝนตกก๊าซ NOv จะทำปฏิกิริยากับน้ำฝนกลายเป็นกรดไนตริกดังสมการ
  3NO2 (g) + H2O(I) -----> 2HNO23(aq) + NO(g)(กรดไนตริก) 3NO2 (g) + H2O(I) -----> 2HNO23(aq) + NO(g)(กรดไนตริก)
  2H+(aq) + NO-3(aq) 2H+(aq) + NO-3(aq)
 กรดไนตริกแตกตัวให้ไฮโดรเจนไอออน (H+) และไนเตรตไอออน (NO-3) ไนเตรตไอออนที่เกิดขึ้น จะตกลงสู่พื้นดินและพื้นน้ำ พืชนำไปใช้สร้างโปรตีนต่อไป กรดไนตริกแตกตัวให้ไฮโดรเจนไอออน (H+) และไนเตรตไอออน (NO-3) ไนเตรตไอออนที่เกิดขึ้น จะตกลงสู่พื้นดินและพื้นน้ำ พืชนำไปใช้สร้างโปรตีนต่อไป
**NO2 ส่วนหนึ่งในบรรยากาศได้จากการเผาไหม้น้ำมันเชื้อเพลิงของเครื่องยนต์
 2. การตรึง N2 ทางอุตสาหกรรม โรงงานผลิตก๊าซแอมโมเนีย (NH3) หรือโรงงานผลิตปุ๋ยได้มีการ ใช้ก๊าซ N2 (แยกจากอากาศ) ทำปฏิกิริยากับก๊าซ H2 โดยวิธีกระบวนการณ์ฮาเบอร์ดังสมการ 2. การตรึง N2 ทางอุตสาหกรรม โรงงานผลิตก๊าซแอมโมเนีย (NH3) หรือโรงงานผลิตปุ๋ยได้มีการ ใช้ก๊าซ N2 (แยกจากอากาศ) ทำปฏิกิริยากับก๊าซ H2 โดยวิธีกระบวนการณ์ฮาเบอร์ดังสมการ
  N2 (g) + 3H2(g) -----> 2NH3(g) N2 (g) + 3H2(g) -----> 2NH3(g)
 ก๊าซ NH3 ที่ได้ส่วนหนึ่งนำไปผลิตปุ๋ยไนโตรเจน เช่น ยูเรียและปุ๋ยที่อยู่ในรูปของเกลือแอมโมเนีย เช่น แอมโมเนียซัลเฟต เมื่อใส่ปุ๋ยลงในดินแบคทีเรีย (Decomposing bacteria) ย่อยสลายไปเป็น ไนเตรต (NO-3) พืชดูดซึมเอาไปใช้ในการสร้างโปรตีน ก๊าซ NH3 ที่ได้ส่วนหนึ่งนำไปผลิตปุ๋ยไนโตรเจน เช่น ยูเรียและปุ๋ยที่อยู่ในรูปของเกลือแอมโมเนีย เช่น แอมโมเนียซัลเฟต เมื่อใส่ปุ๋ยลงในดินแบคทีเรีย (Decomposing bacteria) ย่อยสลายไปเป็น ไนเตรต (NO-3) พืชดูดซึมเอาไปใช้ในการสร้างโปรตีน
 3. การตรึงก๊าซไนโตรเจนทางชีววิทยา แบคทีเรียไนโซเบียมในปมรากถั่วจับก๊าซไนโตรเจนในอากาศ จึงเรียกไรโซเบียมว่า Nitrogen fixing bacteria และเปลี่ยนก๊าซไนโตรเจนเป็นเกลือแอมโมเนียม (NH4+) จากนั้นแบคทีเรียในดิน (Nitrifying bacteria) ทำหน้าที่เปลี่ยน NH4+เป็นสารประกอบไนไตรต์ (NO2- ) และเปลี่ยนสารประกอบไนไตรต์ (NO2-) เป็นสารประกอบไนเตรต (NO3-) ซึ่งพืชดูดซึมนำไปใช้ในการสร้างโปรตีนต่อไป สัตว์กินพืช สัตว์ก็จะนำไปใช้ในการสร้างโปรตีนในสัตว์ เมื่อพืชและสัตว์ตายลง ซากพืชซากสัตว์และสิ่งขับถ่ายจะถูกแบคทีเรีย (Decomposing becteria) ย่อยสลายเป็นสารประกอบไนเตรต (NO3-) ต่อไป 3. การตรึงก๊าซไนโตรเจนทางชีววิทยา แบคทีเรียไนโซเบียมในปมรากถั่วจับก๊าซไนโตรเจนในอากาศ จึงเรียกไรโซเบียมว่า Nitrogen fixing bacteria และเปลี่ยนก๊าซไนโตรเจนเป็นเกลือแอมโมเนียม (NH4+) จากนั้นแบคทีเรียในดิน (Nitrifying bacteria) ทำหน้าที่เปลี่ยน NH4+เป็นสารประกอบไนไตรต์ (NO2- ) และเปลี่ยนสารประกอบไนไตรต์ (NO2-) เป็นสารประกอบไนเตรต (NO3-) ซึ่งพืชดูดซึมนำไปใช้ในการสร้างโปรตีนต่อไป สัตว์กินพืช สัตว์ก็จะนำไปใช้ในการสร้างโปรตีนในสัตว์ เมื่อพืชและสัตว์ตายลง ซากพืชซากสัตว์และสิ่งขับถ่ายจะถูกแบคทีเรีย (Decomposing becteria) ย่อยสลายเป็นสารประกอบไนเตรต (NO3-) ต่อไป
 4. แบคทีเรีย (Denitrifying bacteria) ทำหน้าที่เปลี่ยนสารประกอบไนเตรต (NO3-) เป็น สารประกอบไนไตรต์ (NO2-) ไดไนโตรเจนมอนอกไซด์(N2O) และในที่สุดกลายเป็นก๊าซไนโตรเจนกลับคืนสู่บรรยากาศ 4. แบคทีเรีย (Denitrifying bacteria) ทำหน้าที่เปลี่ยนสารประกอบไนเตรต (NO3-) เป็น สารประกอบไนไตรต์ (NO2-) ไดไนโตรเจนมอนอกไซด์(N2O) และในที่สุดกลายเป็นก๊าซไนโตรเจนกลับคืนสู่บรรยากาศ

 http://www.kme10.com/mo4y2552/mo403/noname19.htm http://www.kme10.com/mo4y2552/mo403/noname19.htm
 |

